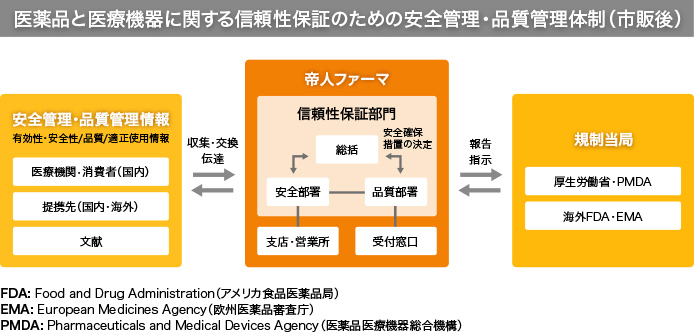
日本では医薬品の製造販売業は許可制です。品質管理および製造販売後安全管理にかかる信頼性保証の方法が、厚生労働省令で定める基準に適合することが条件のひとつになっています。
品質管理の基準を「GQP※1」といい、適合するには品質保証部門を設置して、品質標準書と品質管理業務手順書を作成しなければなりません。品質標準書は厚生労働省から承認を受けた医薬品それぞれについて、成分や分量、製造方法、用法、用量、効能または効果といった最新の品質情報をまとめたもの。品質管理業務手順書は適正な製造管理や品質管理をはじめ、市場への出荷や回収、貯蔵、文書、教育訓練にいたる10のカテゴリーについての詳細なマニュアルです。製造を委託する場合も手順書に従ってさまざまな取り決めを交わします。
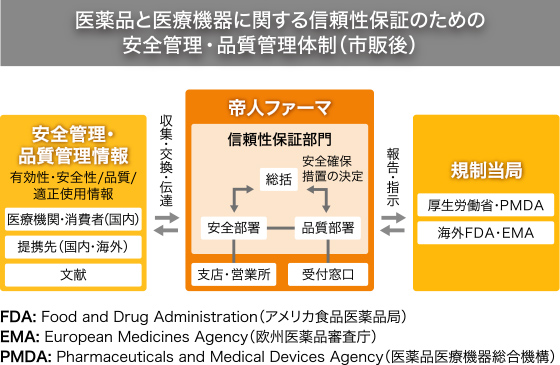
製造販売後安全管理の基準は「GVP※2」と呼ばれます。製品が市場に出たのちに、副作用などの医薬品を使用することに伴うリスクを低く抑えるためのしくみです。安全管理部門の設置や、臨床現場から届く安全管理情報の収集・評価と、必要な措置をとることが求められます。こちらもGQPと同様に詳細なマニュアル作成が必須です。
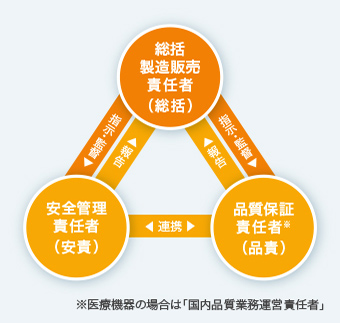
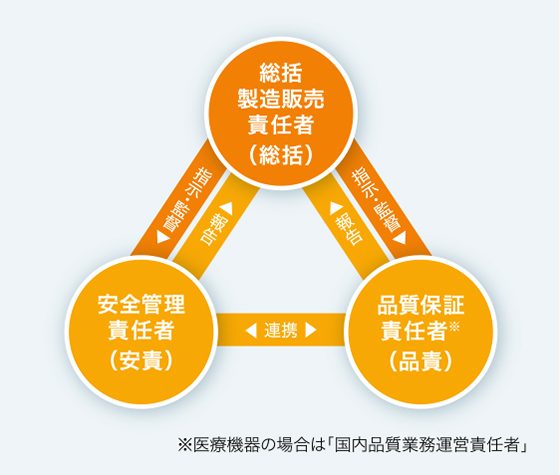
上記の基準を現場で確実に実施できるよう、品質管理と製造販売後安全管理の責務を担う「総括製造販売責任者」を設置するとともに、総括製造販売責任者に品質保証部門の「品質保証責任者」、安全管理部門の「安全管理責任者」を監督することなどが義務づけられています。帝人ファーマでは総括製造販売責任者を取締役が担うことに加え、品質管理と製造販売後安全管理を監督する「信頼性保証部門」を社長直轄とし、ルールの徹底を厳しくチェックしています。
※1GQP=Good Quality Practice
GQP省令=医薬品、医薬部外品、化粧品及び再生医療等製品の品質管理の基準に関する省令
医療機器の場合は、QMS=Quality Management System
QMS省令=医療機器及び体外診断用医薬品の製造管理及び品質管理の基準に関する省令
※2GVP=Good Vigilance Practice
GVP省令=医薬品、医薬部外品、化粧品、医療機器及び再生医療等製品の製造販売後安全管理の基準に関する省令
信頼性保証部門は現在4部・1グループから構成されています。スタッフはいずれも臨床開発、研究や製造、MRなどの他部門で経験を積んだベテランぞろい。現場で培った知見を活かしています。
医薬品の製造販売業者としての品質保証は「医薬保証統括部」、医療機器については「医療保証統括部」が研究段階から製品出荷後まで一貫して管理・統括しており、研究開発、製造、営業などの各部署と緊密に連携しています。
たとえば、臨床試験で使用する治験薬や承認取得後の製品について、医薬保証統括部と担当部署が共同で製造所の確認を行い、品質を確保します。また、市販後医薬品・医療機器の安全管理は「医薬医療情報部」が担当。研究開発や生産技術のセクションと連携しながら、製品の安全性情報や適正使用に関する情報を管理・統括しています。
ほかにも薬事行政などに対応する「薬事部」、当社の製造販売する医薬品が承認書に基づいて適正に製造されるよう現場の点検や評価、教育を行う「医薬品承認書点検グループ」と、専門性に応じたチームがあり、多岐にわたる法令に対応しています。
いずれも多様な部署との協働を円滑にするため、書類だけではなく、膝をつき合わせてのコミュニケーションを大切にしています。
帝人ファーマでは全社員を対象にした薬事教育を毎年実施しています。2018年は「薬害」がテーマでした。薬害肝炎事件を契機に改正された薬事法(現・薬機法)に触れ、国内外の情報を収集・管理することでトラブルを未然に防ぐ安全対策の強化を学びました。
2019年は「ニセ薬」について。ネットなどを通じて個人輸入の医薬品が正規品に紛れる危険性が指摘されており、原料や資材、製品管理の徹底などをあらためて確認しました。
省令では教育訓練についても規定されています。総括製造販売責任者や安全管理責任者、医薬情報担当者(MR)など製造販売後の安全管理に関する業務に従事する者は、あらかじめ作成した訓練計画や手順書に沿って教育訓練を受ける必要があります。さらには、業務が適正に遂行されているかチェックする「自己点検」の実施も定められており、帝人ファーマではMRの一人ひとりに対し教育的側面も配慮したチェックシート形式のアンケートをweb上で行っています。
これら教育訓練も信頼性保証部門が関連セクションと連携しながら主導する業務のひとつです。たとえば製造販売後安全管理にかかわる教育については医薬医療情報部が手順を定め、管理部門員を対象に導入教育を30時間以上、継続教育を年に6時間以上、MRに対しては導入教育を20時間以上、継続教育を年10時間以上と義務づけています。それとは別に、医薬保証統括部による品質保証講習会や、医療保証統括部が在宅医療事業の技術・営業系新入社員に向けて行う品質・信頼性保証に関する研修なども行われています。
教育訓練は複雑な法令の理解や関連知識のアップデートに欠かせません。全社員が「自社製品=患者さんの命に関わるもの」という責任感を持って安全性や品質の確保に力を尽くせるよう、綿密な教育計画を策定しています。

医薬品のリスク管理とは、医薬品そのものの安全性や有効性はもちろんのこと、使用に伴うリスクを低く抑えるための活動や評価、対策などを指します。
製造販売の承認に際して収集された有効性、安全性に関するデータは、臨床試験の限られた条件下で得られたもの。市販後、実際の医療現場でさまざまな性別・年齢・症状の度合いが異なる患者さんに使用される中で、開発段階では予測できなかった効果や副作用が初めてわかることも少なくありません。そのため、製造販売後も引き続き医薬品の有効性、安全性について調査し監視していく必要があります。
製造販売業者は、安全管理責任者の管理のもと医療現場や学会などから得られる安全管理情報を収集。製品によっては、月に数百件の情報が寄せられることもあり、上市直後の新薬にいたっては、数千件におよぶこともあります。その一つひとつを評価担当責任者が因果関係や重篤性などの点から検討し、必要に応じてMRによる医療関係者への情報提供や、お知らせ文書での注意喚起や添付文書の改訂などを行い、適正使用を推進しています。
帝人ファーマの信頼性保証部門は国内・海外の提携先、文献から広く収集した副作用情報を、世界の主要提携企業とも共有できるようデータベース化してリスク管理にあたっています。国内向けには医薬品医療機器総合機構のホームページでリスクマネジメントプランを公開し、医療関係者と情報共有しています。
帝人ファーマは患者さんの生命と健康に関わる製品を社会に提供する使命と責務を担っています。医療環境や法令の変化に迅速かつ柔軟に対応し、患者さんや医療関係者の皆さんに安心して医薬品、医療機器を使用していただけるよう、社員一同、より良い製品とサービスの提供に力を尽くします。
関連リンク
- プロジェクトストーリー 第11回 健康寿命をより長く。脳卒中などの後遺障害に挑むリハビリテーション領域、始動
- プロジェクトストーリー 第10回 多職種の連携をスムーズに。高齢社会を支える地域包括ケアへの取り組み
- プロジェクトストーリー 第9回 帝人ファーマのあゆみ「ゼロからの出発」
- プロジェクトストーリー 第8回 最先端の製剤技術の追求が難病の治療選択肢を広げる - 先端巨大症への挑戦
- プロジェクトストーリー 第7回 慢性呼吸不全に悩む患者さんのQOLを向上する在宅酸素療法のあゆみ【後編】
- プロジェクトストーリー 第6回 慢性呼吸不全に悩む患者さんのQOLを向上する在宅酸素療法のあゆみ【前編】
- プロジェクトストーリー 第5回 服用回数を少なく、より小さく。去痰剤開発で培った「飲みやすい」製剤技術
- プロジェクトストーリー 第4回 新たな現代病、睡眠時無呼吸症候群(SAS)に立ち向かう「スリープメイト®」
- プロジェクトストーリー 第3回 診断方法から開発 - 帝人グループのシナジーを生かし進化する骨・関節領域
- プロジェクトストーリー 第2回 東日本大震災発生!そのとき帝人ファーマは - 災害時の在宅医療支援
- プロジェクトストーリー 第1回 痛風・高尿酸血症の治療に新たな選択肢を - 帝人ファーマの創薬